Importantes avances en el estudio de proteínas transportadoras de membrana
Todas las células necesitan intercambiar iones y moléculas pequeñas con su entorno. Este intercambio tiene lugar de forma controlada mediante proteínas transportadoras de membrana, situadas en la membrana celular. Un subgrupo importante de estas proteínas lo forman las proteínas transportadoras activas, las cuales utilizan energía para transportar el substrato en contra de su gradiente de concentración. Un ejemplo destacado son las proteínas transportadoras de azúcar. Estas proteínas utilizan la energía procedente de gradientes iónicos (normalmente de sodio) o de protones, para transportar las moléculas de azúcar al citoplasma celular. Se trata, pues, de un co-transporte catión-azúcar.
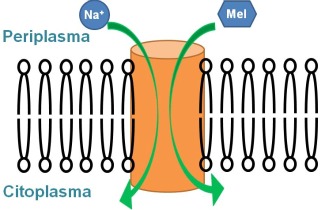
Estos co-transportadores actúan como un conjunto de compuertas que en diferentes etapas facilitan el paso del azúcar y del catión desde el periplasma al citoplasma. El mecanismo de transporte contempla una serie de cambios conformacionales que orientan la proteína hacia el lado periplasmático, permitiendo la unión del sodio y después del azúcar, seguidos de una reorientación hacia el espacio citoplasmático, donde se libera el azúcar y después el sodio. Esta alternancia en la accesibilidad del sitio de unión de los substratos es un mecanismo común a muchas proteínas transportadoras de membrana, y está presumiblemente relacionada con cambios de orientación de algunas de sus hélices transmembrana.
Como primera aproximación al estudio del papel de la reorientación de las hélices transmembrana en la función de las proteínas transportadoras, se ha estudiado una proteína de membrana modelo, la bacteriorodopsina. Esta proteína de 7 hélices α transmembrana es un transportador activo primario que transporta protones mediante la energía de la luz. Para averiguar qué papel juegan los movimientos de las hélices transmembrana, se han introducido dos residuos de cisteína en lugares estratégicos al final de dos hélices adyacentes, mediante mutagénesis dirigida. Induciendo la formación de un puente disulfuro, se consigue restringir el movimiento de esta parte de las hélices. Utilizando diversas metodologías, el análisis de la función de esta proteína modificada en comparación a la proteína nativa revela que las hélices transmembrana se mueven como un cuerpo rígido (1). Esta conclusión se puede extrapolar a otras proteínas de membrana, como el conjunto de receptores acoplados a proteína-G (de 7 hélices α transmembrana), o proteínas transmembrana transportadoras. Este trabajo contribuye a comprender cómo las hélices transmembrana de este tipo de proteínas se mueven para realizar su función.
Para revalidar este concepto en el caso de una proteína transportadora de moléculas pequeñas, se ha estudiado el transportador de melibiosa. Se trata de una proteína con 12 hélices transmembrana, que transporta el disacárido melibiosa aprovechando un gradiente de sodio. Utilizando espectroscopia de diferencia de infrarrojo polarizado, se ha demostrado que la orientación de las hélices transmembrana varía al unir el sodio y la melibiosa (2). Esta evidencia refuerza el concepto de que las hélices transmembrana de los transportadores activos se mueven como cuerpos rígidos para llevar a cabo su función de transporte.
Por otra parte, en un trabajo reciente sobre el transportador de melibiosa, publicado en el Proc. Natl. Acad. Sci. (3), se ha investigado qué aminoácidos están involucrados en la unión de los dos substratos (sodio y melibiosa). Utilizando nuevamente espectroscopia de diferencia de infrarrojo, así como espectroscopia de fluorescencia, se han detectado los cambios conformacionales producidos por la unión de los substratos. Comparando los resultados obtenidos de mutantes seleccionados con la proteína nativa, se han identificado 2 residuos aspártico involucrados en la unión del sodio, y otros 2 residuos aspártico que interaccionan con la molécula de azúcar. Mediante modelos estructurales del transportador de melibiosa, se puede predecir la localización de estos aminoácidos clave en la unión de los substratos: los 4 residuos aspártico se encuentran en 3 hélices transmembrana diferentes. Con los resultados de este trabajo (3), junto al trabajo de diferencia de infrarrojo polarizado (2), se puede proponer que la unión de los substratos provoca un cambio de orientación en las hélices α transmembrana.
Estos estudios pueden aportar conocimientos claves para entender el funcionamiento de transportadores homólogos en humanos, difíciles de estudiar directamente debido a la complejidad de su purificación. Como ejemplos más relevantes encontramos: i) los transportadores de sodio-glucosa, responsables de la reabsorción de glucosa en las nefronas de los riñones. La inhibición controlada de estos transportadores puede ser una buena estrategia para tratar la diabetes mediante el incremento de la excreción del exceso de glucosa por la orina. ii) Los facilitadores de glucosa, responsables de la difusión de la glucosa al citoplasma celular. Estas proteínas forman parte de la familia de los facilitadores mayores de membrana, con las que el transportador de melibiosa comparte una estructura muy similar de 12 hélices transmembrana y la capacidad de la unión de azúcares.
Referencias
1. Rosana Simón-Vázquez, Tzvetana Lazarova, Alex Perálvarez-Marín, José-Luis Bourdelande, and Esteve Padrós (2009) Cross-Linking of Transmembrane Helices Reveals a Rigid-Body Mechanism in Bacteriorhodopsin Transport. Angew. Chem. Int. Ed. 48, 1 – 4.
2. Víctor Lórenz-Fonfría, Meritxell Granell, Xavier León, Gérard Leblanc, and Esteve Padrós (2009) In-plane and out-of-plane infrared difference spectroscopy unravels helices tilt and structural changes in a membrane protein upon substrate binding. J. Amer. Chem. Soc. 131, 15094-15095.
3. Meritxell Granell, Xavier León, Gérard Leblanc, Esteve Padrós and Víctor Lórenz-Fonfría (2010) Structural insights into the activation mechanism of melibiose permease by sodium binding. Proc. Natl. Acad. Sci. USA doi:10.1073/pnas.1008649107.


